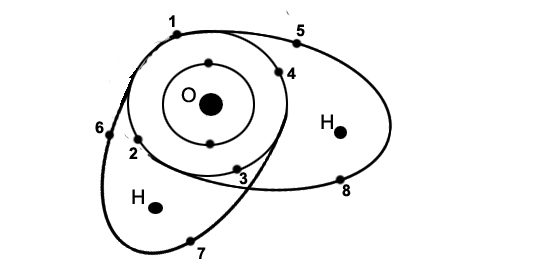
La molécule d'eauSes atomes, ses électronsScrutons la molécule d'eau. Elle est faite d'oxygène et d'hydrogène. L'hydrogène est le plus petit des atomes: un proton seulement. A ce niveau, la couche externe n'est pas de huit, mais de deux électrons. Il lui en manque donc un pour former une configuration stable. Or, il manque deux électrons à l'oxygène sur sa couche externe (voir la molécule, exemple de l'oxygène). Pour obtenir un partage satisfaisant une liaison covalente, ce sont donc deux atomes d'hydrogène qui devront s'unir à un atome d'oxygène.
Les électrons 1 à 4 restent propres à l'atome d'oxygène (O). Les paires 6-7 et 5-8 sont partagées entre O et les atomes d'hydrogène (H).
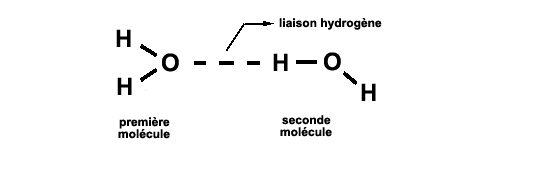
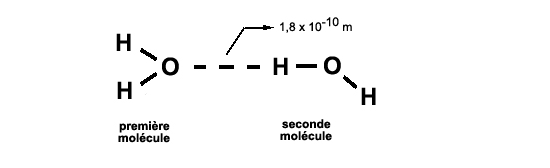
(sur fond gris: les électrons partagés) PolarisationCette molécule d'eau, formée de deux très petits atomes d'hydrogène et d'un atome d'oxygène plus gros, sera en outre polarisée: vu de l'extérieur, la partie "oxygène" apparaîtra plus riche en électrons, et les parties "hydrogène" moins riches: la partie oxygène apparaîtra négative, les parties hydrogène positives. Ceci permettra à deux molécules d'eau de se lier d'une manière originale: chaque hydrogène sera attiré par l'oxygène d'un autre atome, et pourra former avec lui une liaison d'un type spécial: la liaison hydrogène
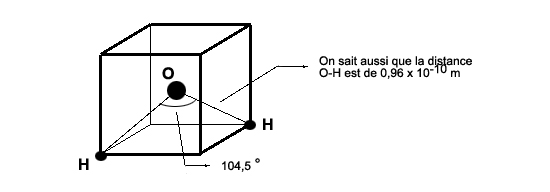
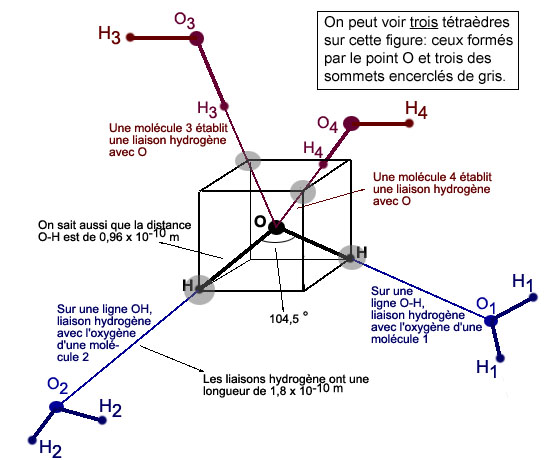
(pn devine ici que chaque molécule pourra contracter quatre liaison hydrogène: une via chaque atome d'hydrogène, et deux via l'atome d'oxygène, comme on le détaillera plus loin) Liaison certes plus faible (environ dix fois) que la liaison covalente , mais suffisante pour maintenir une certaine cogésion de l'eau. Géométrie: un tétraèdreLa molécule d'eau a sa géométrie bien à elle: les deux liaisons O-H forment entre elles un angle de 104,5 degrés. Cet angle est très proche de 109,5 degrés, angle que forment entre elles les lignes droites joignant le centre d'un tétraèdre régulier à deux de ses sommets. Il suffit donc de dessiner une face d'un tétraèdre régulier pour représenter dans l'espace, à peu de choses près, les trois atomes de la molécule d'eau. Et la face d'un tétraèdre régulier peut se construire à partir du centre et de deux sommets d'un cube.
Pour ensuite représenter les liaisons avec les molécules voisines, nous disposons des informations suivantes. 1) Les deux liaisons hydrogène allant
vers deux molécules voisines répondent aux deux
propriétés suivantes: Ce qui, au total, nous donne la figure suivante.
(Cliquer ICI pour accéder à une version progressive de cette figure) A partir de ceci, nous pouvons comprendre trois causes des extraordinaires propriétés de l'eau. Première cause. La structure tétraédrique est peu compacte: chaque atome n'a que quatre voisins, alors que dans certains solides on peut en compter 6, 8 ou même 12 ! Cela laisse la place à d'autres ions, qui peuvent être littéralement enrobés par une ou plusieurs couches de molécules d'eau. Deuxième cause. La liaison hydrogène est assez faible. En fait, à la température ambiante, elle se fait et se défait environ ... mille milliards de fois par seconde !! C'est pourquoi l'eau est un liquide. En la refroidissant, on diminue l'agitation et on obtient une structure stable: la glace, qui dans certaines circonstances s'ordonne en beaux cristaux.
Troisième cause. A l'état
liquide, l'extrême agitation de l'eau lui permet aussi d'établir
des liens hydrogène (voir plus haut) temporaires avec d'autres
ions, s'ils sont présents.
Et ce peuvent être des ions aussi bien positifs que négatifs,
pourvu qu'ils soient polarisés. |
|||||||||||||||||||||