

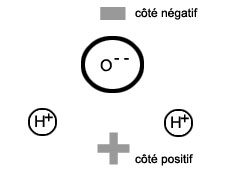
Ioniser par dissolutionCertains liquides sont d'excellents solvants, c'est-à-dire qu'ils sont capables d'absorber certaines matières, liquides ou solides, au point de les rendre invisibles. Le sel de cuisine dans l'eauL'eau est un de ces solvants. C'est aussi un liquide très particulier, qui joue un rôle important sur terre. Ses molécules ont notamment la particularité d'être polaires.
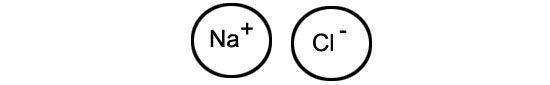
Cela signifie que les charges négatives et les charges positives ne sont pas également réparties dans la molécule: un côté de celle-ci (le côté de l'atome d'oxygène) est plus négatif, et l'autre (du côté des atomes d'hydrogène), plus positif. Or, les molécules de certaines matières, comme le sel de cuisine, ont la particularité de se scinder facilement en deux ions, l'un positif et l'autre négatif.
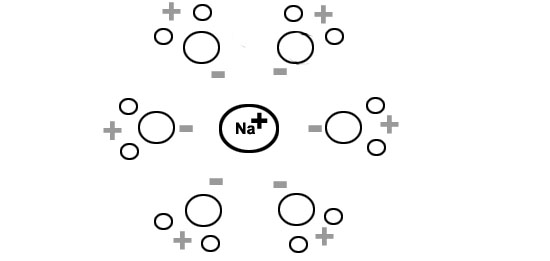
Et justement, les côtés positifs et négatifs des molécules d'eau ont une force d'attraction suffisante pour scinder les molécules de sel. Surtout si elles se mettent à plusieurs, en se groupant en grappes autour des ions de sodium.
(il faut voir ceci dans l'espace: il s'agit d'une sphère, non d'un cercle) Ions plus compliqués: les roches se dissolventLa dissolution peut porter sur des ions plus compliqués. Un exemple très connu est la dissolution des roches calcaires sous l'action de l'eau chargée en CO2. En langage chimique: L'eau et le CO2 se combinent pour former de l'acide carbonique: CO 2 + H2O La roche calcaire, constituée de carbonate de calcium insoluble dans l'eau, est attaquée par l'acide carbonique: H2CO3 + CaCO3 pour former l'hydrocarbonate soluble Ca(HCO3)2, qui se dissout dans l'eau en se séparant en deux ions: Ca(HCO3)2 C'est ce processus qui est à la base de la formation des grottes. |

 Ca(HCO3)2
Ca(HCO3)2