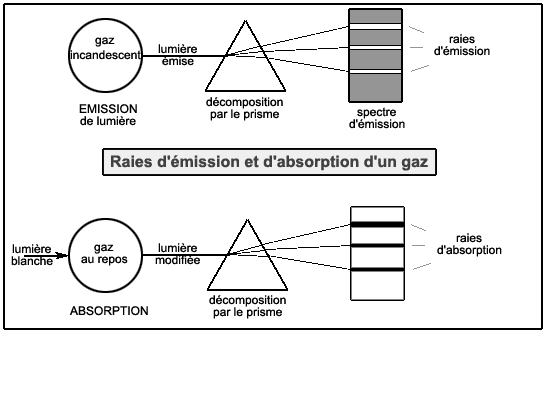
Le modèle de BohrSpectres et raiesCette fois, c'est l'étude des raies spectrales qui allait permettre de dépasser le modèle planétaire de Rutherford. Que sont les raies spectrales? On sait depuis Newton qu'en faisant passer une lumière blanche dans un prisme, on la décompose en une infinité de couleurs, couvrant un large spectre de longueurs d'onde. Que se passe-t-il si l'on décompose de la même manière une lumière émise par un gaz (l'hydrogène, par exemple) porté à l'incandescence? Il se passe quelque chose d'étrange: au lieu d'un spectre continu, on obtient un spectre réduit à quelques fines zones, ou raies. Ces raies sont en quelque sorte la signature du gaz, qui le distingue des autres au point qu'elles permettent de l'identifier lors de l'analyse de la lumière émise par les étoiles les plus lointaines. On parle de raies d'émissions. Un phénomène similaire se manifeste lorsque le gaz est au repos, et qu'on le fait traverser par un rayon de lumière blanche: si on analyse ce rayon après la traversée du gaz, on constate des lacunes (raies noires) dans son spectre. Et ces raies sont situées au même endroit du spectre que les raies d'émission!
Pourquoi cette émission et cette absorption dans quelques longueurs d'onde seulement? Faute de comprendre cette discontinuité, le physicien suisse Balmer, peu après 1890, parvint à établir une formule permettant de calculer les longueurs d'onde de ces raies, du moins pour l'hydrogène. Voici sa formule, qui donne la longueur d'onde Ln de la nème raie du spectre de l'hydrogène: 1/Ln = R ( (1/22) - (1/n2) ) où R est la constante de Rydberg, propre à chaque élément.
Dans cette formule, chaque raie (dans le domaine du visible) correspond à une valeur entière de n: 3, 4, 5,... Etonnant: cette formule fait donc correspondre chaque raie visible de l'hydrogène à un nombre entier 3, 4, 5, ... !
La lumière par grainsIl y avait un point commun entre la
discontinuité mise en formule par Balmer et les idées
de Planck (1900), bientôt reprises par Einstein (1905), selon
lesquelles la lumière
était émise par bouffées, chaque bouffée
ayant, pour une longueur d'onde h = 6,62.10-34 Joules x secondes Il appartint à Bohr d'élaborer, en 1913, un nouveau modèle de l'atome qui tenait compte de tout ce qui vient d'être dit.
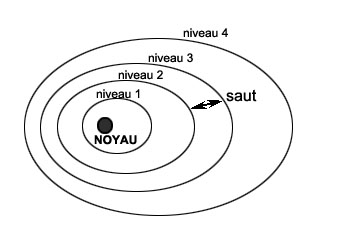
Par exemple, le spectre de l'hydrogène contient une raie de longueur d'onde 656,3 nanomètres. Cette raie correspond au saut d'un électron du niveau 2 vers le niveau 3 (raie d'émission) ou vice-versa (absorption). Très schématiquement (rappelons que les échelles ne sont ici pas respectées):
Application: Dans la couche 3 (n = 3) de tout atome,
il y a ainsi trois sous-couches, numérotées
|