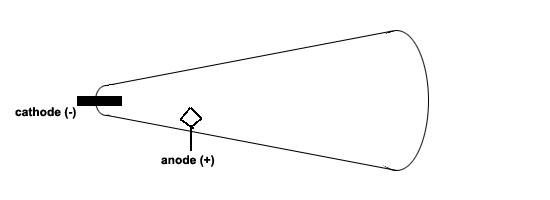
Un pudding aux électronsC'est en identifiant son composant le plus volage, l'électron, que l'on progressa d'abord dans la connaissance de l'atome. A la fin du XIXème siècle, les recherches sur l'électricité avaient bien progressé, et notamment on connaissait, à l'époque, les "rayons cathodiques", produits dans le "tube de Crookes", dont le principe était très simple. Il s'agissait d'un grand tube, contenant un gaz sous très faible pression. On créait, entre une cathode (négative) et une anode (positive), une tension électrique très élevée (5 à 10 000 volts):
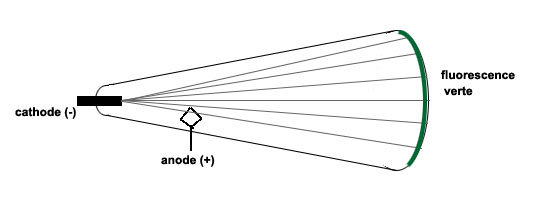
On constatait qu'un rayonnement était alors produit, car ces rayons venaient frapper le fond du tube, qui émettait alors une lumière verte (fluorescence du verre):
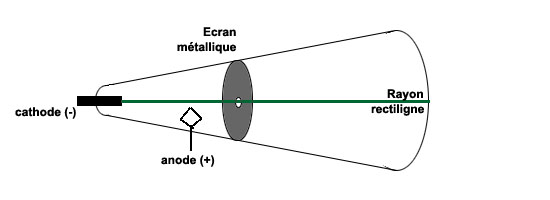
Ce rayonnement était arrêté par tout objet métallique. On pouvait donc l'empêcher de se disperser: en disposant sur son trajet des plaque métalliques trouées, on lui imposait une trajectoire rectiligne, qui se maintenait jusqu'à la paroi du fond:
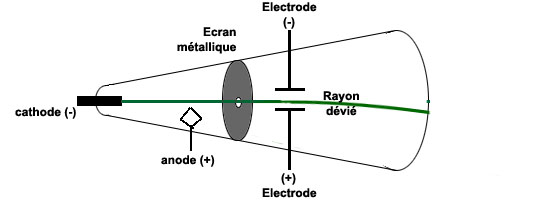
Thomson, en 1897, s'aperçut que l'on pouvait dévier le rayon en le faisant passer entre deux plaques électriquement chargées (10 volts):
Il en déduisit que ces rayons étaient en fait des particules de charge négative, et leur donna le nom d'électron, nom qui avait été créé en 1891 par l'irlandais Stoney. Pour plus de détail, voir par exemple: Il était donc possible d'arracher des électrons aux rares atomes de gaz encore contenus dans le tube. Ayant mesuré la déviation que subissait l'électron en passant entre les deux plaques chargées, Thomson put alors calculer le rapport entre sa charge et sa masse:
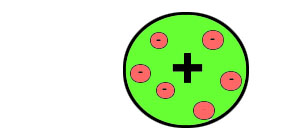
Par ailleurs, il lui semblait évident que, amputé d'un ou plusieurs électrons, l'atome devenait positivement chargé. L'atome était donc composé d'électrons négatifs et d'une masse positive que, faute de mieux, il voyait comme relativement informe:
L'atome, pour lui, ressemblait à une sorte de pudding aux électrons. |